
El científico alemán Georges Köhler (izquierda) y el argentino César Milstein desarrollaron el método para producir los anticuerpos monoclonales y fueron reconocidos con el Nobel de Medicina en 1984.
El Amanecer de la Inmunología Humoral
La historia de los anticuerpos no es solo la historia de una molécula, sino de la propia inmunología. A finales del siglo XIX, la medicina vivía una era de descubrimientos bacteriológicos sin precedentes.
En este contexto, Emil von Behring y Shibasaburo Kitasato sentaron las bases de la inmunidad humoral. Sus experimentos demostraron que el suero de animales inmunizados contenía «antitoxinas» capaces de neutralizar enfermedades letales como la difteria y el tétano. Poco después, el genio silesio Paul Ehrlich, tras doctorarse con una tesis sobre colorantes histológicos y recuperarse de una tuberculosis en el clima seco de Egipto, se unió al equipo de Robert Koch en Berlín.
Ehrlich fue quien acuñó el término «balas mágicas» (magische Kugeln). Su visión era tan poética como científica: compuestos químicos con una afinidad tal que buscaran y destruyeran selectivamente a los patógenos sin rozar las células sanas. Su Teoría de la Cadena Lateral (1897) fue la primera explicación bioquímica rigurosa sobre cómo los receptores celulares interactúan con las toxinas, un trabajo que le otorgó el Premio Nobel en 1908.

Dr. Ehrlich’s Magic Bullet (su título en español, La bala mágica), película sobre Paul Ehrlich dirigida por William Dieterle y protagonizada por Edward G. Robinson. Su estreno fue en 1940 y fue nominada al Óscar al mejor guion original en la primera ocasión que se premió esta categoría.
La Disputa de los Modelos: Instruccionismo vs. Selección Clonal
Durante la primera mitad del siglo XX, la ciencia intentó explicar cómo se generaba la diversidad de los anticuerpos:
- Karl Landsteiner: El descubridor de los grupos sanguíneos centró la respuesta inmune en la molécula del anticuerpo y sustituyó el término «toxina» por el de antígeno.
- La Teoría Instruccionista: Junto a Linus Pauling, sugirieron que el antígeno actuaba como un molde físico sobre el cual el anticuerpo se plegaba para adquirir su forma.
- La Revolución de la Selección Clonal: En los años 50, Niels K. Jerne propuso que los anticuerpos ya preexistían en el organismo. Poco después, Frank Macfarlane Burnet y David Talmage perfeccionaron este modelo: cada linfocito B produce un solo tipo de anticuerpo con una especificidad única, generada al azar. Al entrar el antígeno, este no «instruye» a la célula, sino que «selecciona» al clon adecuado para que prolifere.
El Salto Cuántico: La Tecnología del Hibridoma (1975)
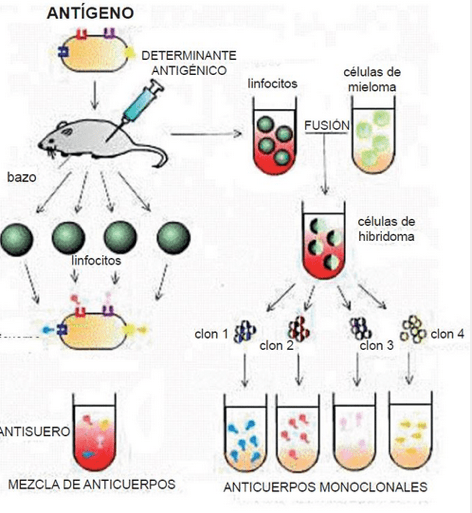
A pesar de conocer la teoría, la medicina tenía un problema práctico: los anticuerpos policlonales. Al inmunizar a un animal, se obtenía una mezcla heterogénea de anticuerpos que reconocían diferentes partes del antígeno, eran difíciles de estandarizar y se agotaban al morir el animal.
En el Laboratorio de Biología Molecular de Cambridge, el argentino César Milstein y el alemán Georges Köhler resolvieron este dilema mediante la fusión celular:
- Linfocitos B: Extraídos del bazo de un ratón inmunizado. Poseen la «llave» (el anticuerpo específico) pero mueren rápido en cultivo.
- Células de Mieloma: Células tumorales inmortales que proliferan indefinidamente pero producen proteínas defectuosas.
Al fusionarlas, crearon el Hibridoma: una fábrica inmortal capaz de secretar una línea infinita de un solo anticuerpo puro y homogéneo. Este descubrimiento, publicado en Nature, les valió el Nobel en 1984.

El proceso de obtención de hibridomas, combina la inmunología clásica con la ingeniería celular, y es el que permite obtener una línea de producción inagotable de «balas mágicas». Se pueden diferenciar cinco etapas:
- Inmunización Dirigida: El proceso se inicia inoculando antígenos específicos en un modelo murino (ratón). El objetivo es activar su sistema inmunitario para que los linfocitos B comiencen a diseñar anticuerpos contra ese agente extraño.
- Cosecha de Células B: Una vez lograda la respuesta inmune, se procede a la extracción de las células B del bazo del animal. Estas células poseen la especificidad deseada, pero tienen un inconveniente biológico: son incapaces de sobrevivir de forma prolongada en condiciones in vitro.
- Fusión Celular (Hibridación): Para dotarlas de longevidad, estas células B se mezclan con células de mieloma (tumorales). Estas últimas han sido seleccionadas previamente por ser deficientes en la producción de anticuerpos propios y por ser vulnerables a ciertos agentes de selección.
- Selección en Medio HAT: Tras la fusión, la mezcla resultante se cultiva en un medio específico denominado HAT, que actúa como un riguroso tamiz biológico.
- Las células de mieloma no fusionadas mueren por su incapacidad enzimática ante el medio.
- Las células B no fusionadas perecen naturalmente por su corta vida media.
- Resultado: Solo sobreviven los hibridomas, aquellas células híbridas que han heredado la inmortalidad del mieloma y la capacidad metabólica de la célula B.
- Clonación y Expansión: Finalmente, los hibridomas supervivientes se evalúan para identificar cuál de ellos produce el anticuerpo de interés con mayor pureza. Una vez seleccionado el clon idóneo, se aísla y se expande, garantizando una fuente perpetua de anticuerpos monoclonales idénticos.
Este refinado procedimiento es el que permite que hoy dispongamos de terapias de una precisión molecular asombrosa.
La Evolución de la Humanización
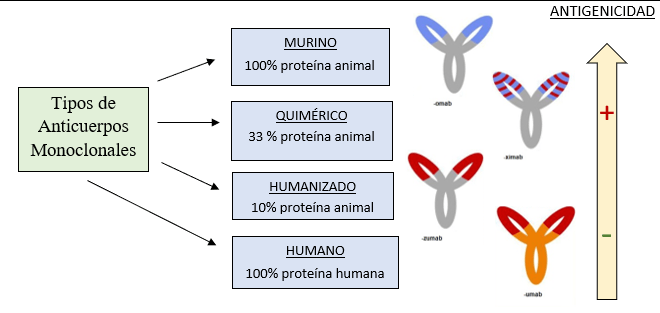
Milstein, un visionario, entendió que el cuerpo humano rechazaría los anticuerpos de ratón (murinos). Para evitar esto, la biotecnología ha seguido un camino de «humanización» progresiva:
- Murinos (100% ratón – OMAB): Como el Muromonab-CD3 (1983), pionero en trasplantes pero con alto riesgo de rechazo.
- Quiméricos (65% humanos – XIMAB): Combinan regiones variables de ratón con constantes humanas. El Rituximab (1997) cambió el pronóstico del linfoma al marcar las células B para que las Natural Killer las eliminen.
- Humanizados (90% humanos – ZUMAB): Solo las regiones determinantes de complementariedad (CDR), la «llave» misma, son de ratón. Ejemplos son el Trastuzumab (cáncer de mama) y el Infliximab (anti-TNF para Crohn).
- Humanos (100% humanos – UMAB): Obtenidos por ratones transgénicos o bibliotecas de fagos (Nobel 2018). El Adalimumab es el exponente máximo, permitiendo remisiones en artritis reumatoide con administración domiciliaria.
El Cambio de Paradigma en Oncología y el Futuro
Los anticuerpos monoclonales han redefinido el tratamiento del cáncer. Ya no solo atacan al tumor, sino que actúan como bloqueantes de puntos de control.
El Ipilimumab (anti-CTLA4), por el cual James P. Allison recibió el Nobel en 2018, no ataca al cáncer directamente, sino que quita el «freno» al sistema inmune para que sea el propio cuerpo quien destruya el melanoma.
Finalmente, la investigación nos lleva a:
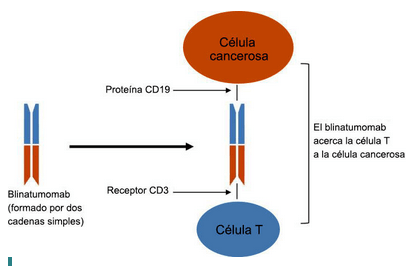
- Anticuerpos Biespecíficos: Pueden unirse a dos objetivos o antígenos diferentes al mismo tiempo. Por ejemplo, unir una célula cancerosa con una célula de defensa o linfocito, abriendo así, como si fuese una llave maestra, dos puertas distintas. Como el Blinatumomab, que une físicamente una célula cancerosa con un linfocito defensor.
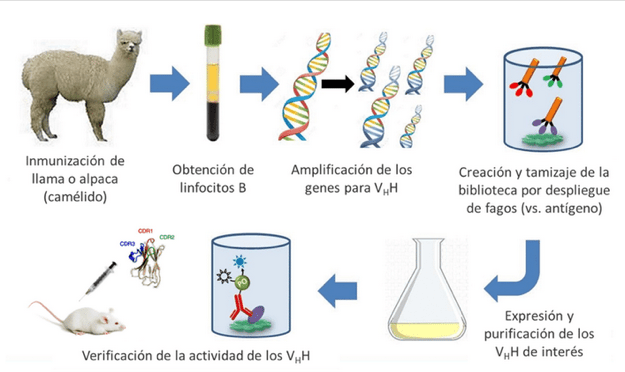
- Nanocuerpos: Derivados de camélidos (llamas, dromedarios) y tiburones. Son tan minúsculos que pueden atravesar la barrera hematoencefálica para tratar el Alzheimer o penetrar hasta el núcleo de tumores sólidos. Su estabilidad es tal que podrían administrarse en spray nasal.
Conclusión
Hoy, los anticuerpos monoclonales representan más del 40% de los fármacos en desarrollo y son herramientas esenciales tanto en terapia como en diagnóstico (desde el test de embarazo hasta la biopsia de precisión). Son, en esencia, la realización del sueño de Ehrlich: la ciencia básica transformada en una herramienta de precisión industrial que ha cambiado la medicina para siempre.
Referencias principales
García Merino A. Anticuerpos monoclonales. Aspectos básicos. Neurología. 2011; 26(5): 301-306.
González-Fernández A, Díaz de Espada F. Milstein: 35 años de anticuerpos monoclonales. Inmunología, 2011; 30(1): 30 33. Alberto Fossati C. César Milstein. Ac Bioquim Clin Latinoamerican. 2022; 56(2): 201-5
American Cáncer Society. Anticuerpos monoclonales y sus efectos secundarios. 2023.
Rama-Bello D, Llorente L. Cincuentenario del descubrimiento de la estructura química de los anticuerpos. Reumatol Clin. 2009; 5(6): 280-84.
Deja un comentario